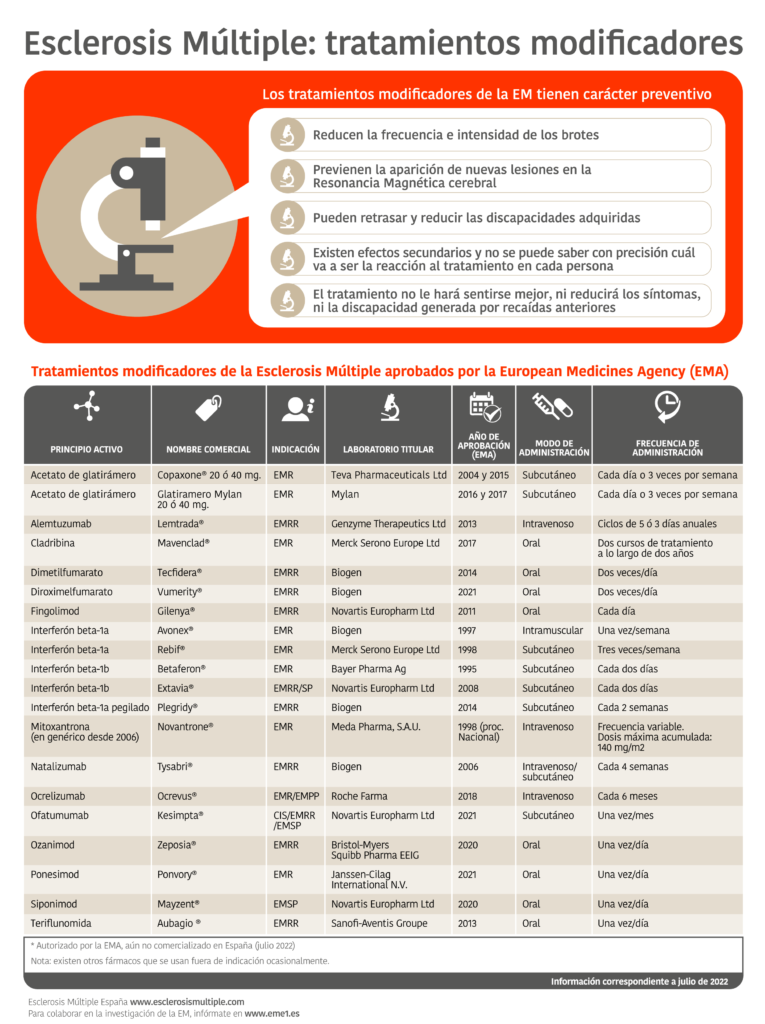
Poco más de un año después de que la Comisión Europea aprobase Mayzent (siponimod) para Esclerosis Múltiple, en un contexto marcado por la pandemia de COVID-19, España ya ha aprobado la comercialización de este tratamiento, el primer y único oral indicado específicamente para pacientes con Esclerosis Múltiple Secundaria Progresiva activa.
El fármaco ha demostrado ser eficaz en el retraso de la progresión de la discapacidad y del deterioro de la velocidad de procesamiento cognitivo y la reducción del número de brotes. La nueva alternativa terapéutica, financiada por el Sistema Nacional de Salud, se dispensará únicamente en farmacia hospitalaria con indicación restringida a pacientes adultos con EMSP activa definida por brotes o características de imagen típicas de actividad inflamatoria.
El ensayo EXPAND, desarrollado en 292 hospitales de 31 países, ha contado con la implicación de 106 pacientes en fase principal en 14 hospitales españoles y demostró que en pacientes con EMSP y enfermedad activa, Mazyent redujo el riesgo relativo de progresión de la discapacidad. Los pacientes tratados de forma temprana y continua con este medicamento experimentaron un menor riesgo de progresión de la discapacidad que los pacientes que iniciaron su tratamiento con la terapia en régimen abierto tras la fase principal.

Fuente consultada de la actualización: El Español
Más información:
-La Comisión Europea aprueba Mayzent (siponimod) para Esclerosis Múltiple Secundaria Progresiva
-La FDA aprueba un nuevo medicamento para la Esclerosis Múltiple: Mayzent













Me esposo tiene esclerosis múltiple y nos gustaría saber más de esta medicina. Muchas gracias
Alguien sabe de algún estudio comparativo de Mayzent versus Ocrevus?
También querría saber si alguna unidad médica en España está aplicando el protocolo Coimbra (altas dosis de Vitamina D) en pacientes con EM y si los pacientes muestran una respuesta positiva.
Gracias,
Josema